一种新药的上市,必须经过科学严格的临床试验,如果某种疾病已有或类似上市药物,国家要求制药企业需要选择其作为对照,来验证研发的新药相对于已有的药物是否有疗效。
根据试验的目的不同,常用的方法有非劣效、优效、等效检验。
美国FDA指导原则描述了四种对照试验来验证药物的有效性,其中的安慰剂、空白对照和剂量反应对照均属于优效性试验,另外一种是阳性对照(非劣效性试验),也可以是优效性试验,但一般用于验证新药和阳性对照药之间的差异很小,小到足可以用阳性药的有效性来支持新药也是有效的。
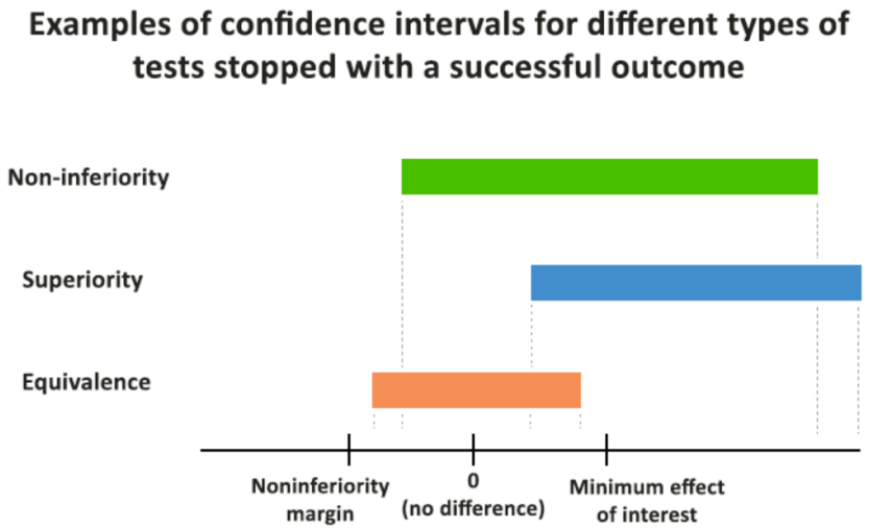
验证试验药的疗效在临床意义上不差于(非劣于)对照药(阳性药)的试验。
在试验设计阶段.需要提前设定一个临床非劣效界值,试验结束后,根据提前设定的界值,来判定试验药物与阳性药物的差异是否有统计意义。
验证试验药的疗效与阳性药物的疗效之间的差别在临床上并无重要意义。
通常通过比较两者差值在临床上可以接受的等效上下界值之间来证实。
验证试验药的疗效在临床意义上优于阳性药物(阳性或安慰剂对照)的疗效。
在试验设计阶段,同样需要设定一个临床优效界值。
在优效性试验中,界值指试验药与对照药之间相差的临床上认可的最小值,在非劣效性和等效性试验中指临床上可接受的最大值。
对非劣效性/等效性试验,它必须小于阳性对照与安慰剂比较时的效应差值,可取其1/3或1/2。
界值的确定需要由主要研究者从临床意义上和统计学专业人员从统计学意义上共同商定,而不是单独依赖于主要研究者或统计学专业人员。
优效性试验和非劣效性试验仅用一个界值,用δ0表示;
而等效性试验要用劣侧和优侧两个界值,分别用δ1和δ2表示,理论上两侧界值可以取不等距,但实际上一般取等距。
界值确定必须在试验设计阶段完成,并在试验方案中阐明,如有修订,必须在揭盲之前进行并陈述理由,一旦揭盲,不得更改。
这一点很重要,若不遵守,则很容易陷入“数字游戏”的危险。
根据既往的经验,对有些临床定量指标具有专业意义上的变化量,可提供粗略的界值参考标准,例如血压可取为0.67kPa,胆固醇可取为0.52mmol/L,白细胞可取为0.5×109/L。
非劣效性/等效性试验经常是对变化量间的比较,相应的界值(指变化量之问的差值)应更小,例如血压变化值的等效界值可取为0.4kPa,胆固醇变化值可取为0.26mmol/L,白细胞变化量可取为0.2×10 9 /L。
当难以确定时,可酌取1/5~1/2个标准差或参比组均数的1/10~1/5等。
对两组率而言,建议取15%以下的值,通常最大不超过对照组样本率的1/5。
当然,界值也能过小。
举个例子:
为了显示一种新药血管紧张素Ⅱ拮抗剂治疗轻中度原发性高血压的降压效果不差于标准药血管紧张素转换酶抑制剂(ACEI),主要终点指标用仰卧舒张压的下降幅度,应如何考虑制定非劣效性界值的问题?
既往ACEI与安慰剂的对照试验显示最小的药物效应差值△为1.34kPa(10mmHg),基于临床考虑,认为用δ0=0.40kPa(约为△的1/3)作为非劣效性试验的界值是合理的,即只要新药的平均降压不比ACEI的平均降压值小0.40kPa或更多,则可认为新药与ACEI相比为非劣效。
当然,若适当放宽控制非劣效的标准时,δ的取值可稍微大些,例如δ0=0.67kPa(为△的1/2)。
参考文献:
[1]李新旭,周军,高丽丽,王骏.非劣效临床试验的总结与思考[J].中国新药杂志,2020,29(13):1469-1477.


发表评论 取消回复